단백질: 몸을 구성하는 성분
- 단백질은 우리 몸을 구성하는 3대 영양소 중 하나임. 다른 두개는 탄수화물과 지방이 있음. 주로 근육을 만들 때 사용된다는 단백질에 대해 알아보자.
단백질의 기본 설명
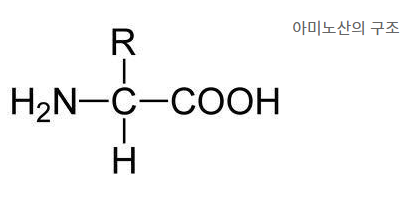
- 단백질은 아미노산이 합쳐져서 만들어짐
- 약 20가지 종류의 아미노산이 생명체를 구성함
- 아미노산은 산과 염기로 작용할 수 있는 양쪽성이온으로 존재함
- 아미노산의 아미노기(-NH2)와 카복실기(-COOH)가 여러개 결합되면 단백질임
- 이런 결합을 펩타이드 결합이라고 부름
- 펩타이드 그룹은 동일 평면상에 존재함
- 펩타이드의 C-N bond는 부분적 이중결합이 특징임
- 펩타이드의 C-N bond는 자유로운 회전이 불가능함
- 펩타이드의 합성은 Amino terminal에서 Carboxyl terminal 방향으로 진행됨 (N→C)
- 아미노산은 결합을 하면 결합 사이사이에 등전점이 생김
등전점
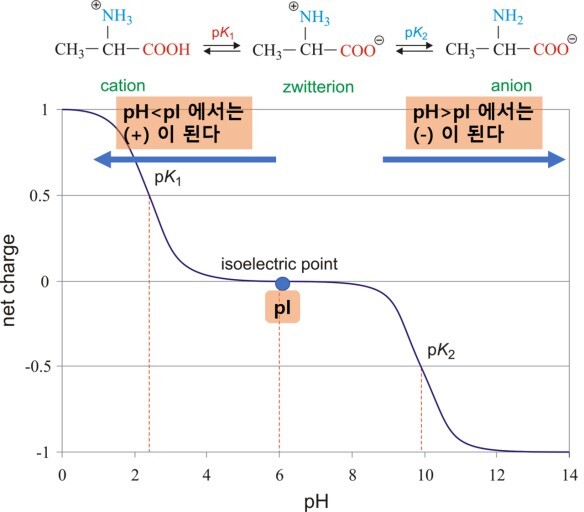
(1) Net charge가 zero가 되는 지점
(2) 양전하, 음전하 모두 가짐
(3) 약산임과 동시에 짝염기임
(4) 수소이온 공여체이고 동시에 수용체임
- 단백질은 자기의 등전점보다 낮은 pH에서 양이온교환수지와 결합함
- 등전점보다 낮은 pH에서 아미노산은 총전하(Net charge) 양의 값을 가짐
- 단백질은 자기의 등전점보다 높은 pH에서 음이온교환수지와 결합함
- 등전점보다 높은 pH에서 아미노산은 총전하 음의 값을 가짐
- 등전점과 같은 pH에서 아미노산은 총전하 제로의 값을 가짐
- 등전점과 같은 pH에서 아미노산은 약산임과 동시에 짝염기임
- 양이온 교환수지에 결합된 단백질은 단백질 등전점 이상의 pH에서 분리됨
- n개 아미노산이 결합해 n-1개 펩타이드 결합을 형성함
단백질의 구조 - 4가지
- 1차 구조란 그냥 아미노산 서열을 말함
- 2차 구조에는 α-나선, β-병풍이 있음
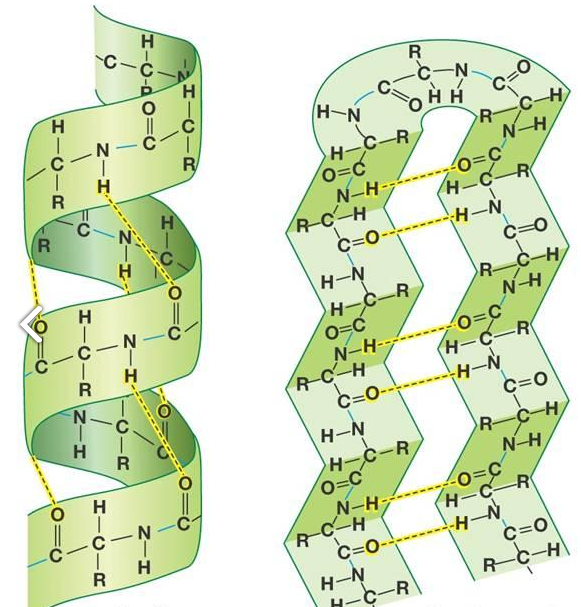
- α-나선은 우선형 나선구조임
- α-나선 안의 모든 C=O와 N-H는 사슬 내의 수소결합에 참여함 (말단 제외)
- β-병풍은 펼쳐진 병풍구조를 가짐
- 소해면상뇌증(Bovine Spongiform Encephalopathy)의 원인체는 2차 단백질인 프리온임
- 정상 프리온 단백질은 α-helix형태이며, 비정상 프리온 단백질은 β-pleated sheet 형태임
- 정상 프리온 단백질은 뇌와 신경계에 존재하는 glycoprotein임
- 비정상 프리온 (abnormal prion) 단백질은 다른 정상 프리온에 전염됨
- 이종간에 전염성이 있음 (섭취)
- 비정상 프리온(abnormal prion) 단백질은 체내에 단백질분해효소에 의해서 아미노산으로 분해되지 않음 ㅎ ㄷ ㄷ
- 3차 구조에는 섬유상 단백질, 구형 단백질 등이 있음
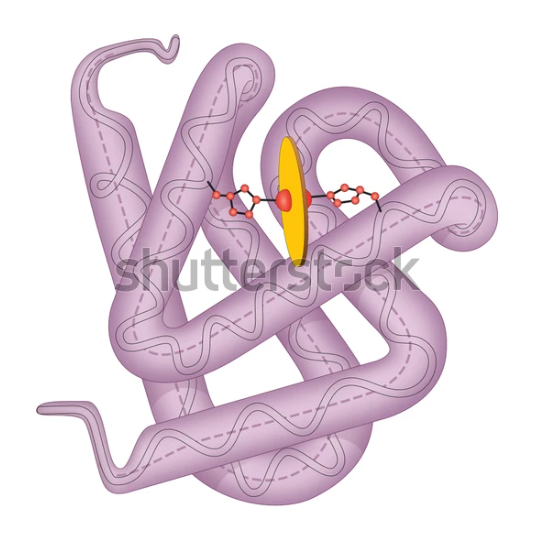
- 섬유상 단백질: α, β-keratin, 콜라겐
- α-keratin: 머리카락, 뿔, 손톱 및 피부 표피층
- β-keratin: 새의 비늘, 부리, 발톱 및 깃털
- 구형 단백질: 미오글로빈, 효소 단백질, 알부민, 글로불린, 프로타민 등 응축된 형태
- 콜라겐의 각 가닥은 좌선형 나선구조를 가짐
- 3개의 각 가닥이 꼬여서 우선형 나선인 콜라겐을 만듦. 즉, 구성성분은 좌선형이고 최종물질은 우선형임
- 3차 구조에는 펩티드 결합, 수소결합, 이황화 결합, 반데르발스 결합, 이온 결합이 존재함
- 4차 구조는 3차 구조가 서로 결합하여 형성됨
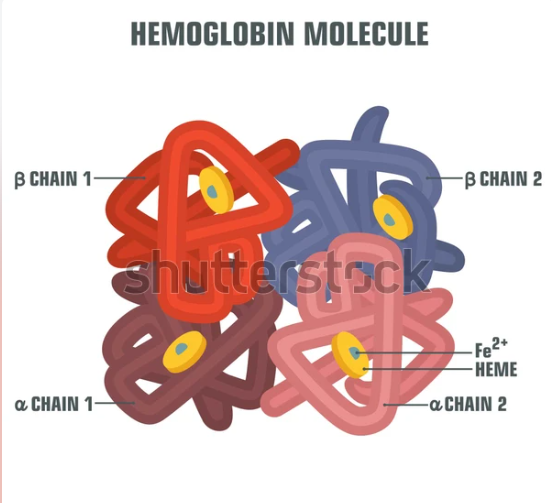
- 4차 구조 단백질로는 헤모글로빈(4개의 Heme), DNA 중합효소, 이온 통로가 있음
헤모글로빈
- 산소의 결합은 헤모글로빈의 3차 구조에 미세한 변화를 일으킴
- 산소의 결합은 헤모글로빈의 4차 구조에 커다란 변화를 일으킴
-> 즉, 산소의 결합이 3,4차구조 모두에 영향을 미침
- 2,3-BPG(2,3-Bisphosphoglycerate)는 조직내에서 헤모글로빈으로부터 산소가 잘 유리되도록 도와주는 생리물질임
- Bohr effect란 pH가 낮으면 Hb의 산소결합력이 낮아지는 현상임
- 낫세포 빈혈증(sickle cell anemia)는 유전적 돌연변이에 의하여 헤모글로빈간의 소수성 결합이 많아져서 생김 (전하성 아미노산이 소수성 아미노산인 Valine으로 변하기 때문에) -> 말라리아에 거의 면역
단백질 검사 법
- Molecular exclusion chromatography에서는 분자량이 큰 단백질일수록 빠져나오는 속도가 빠름
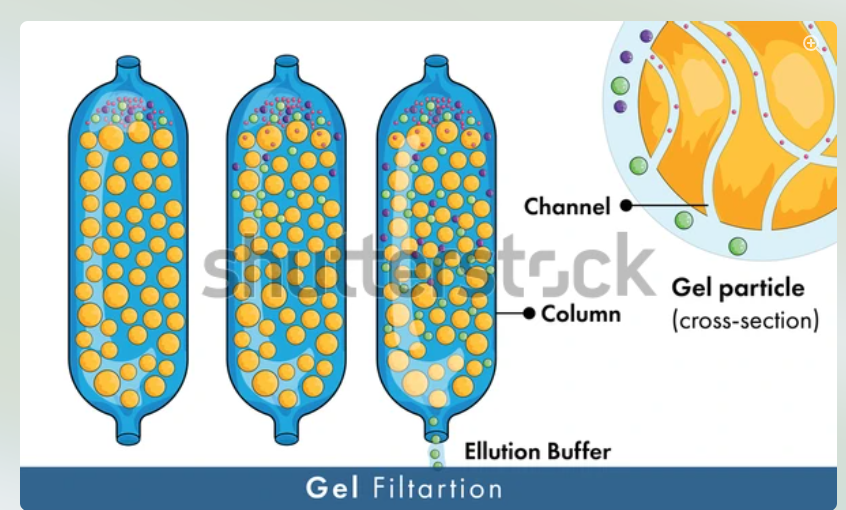
- 단백질 분자량 크기의 순서가 A>B>C이면 molecular exclusion chromatography에서 빠져나오는 순서는 A > B > C 임(작은 애들의 이동경로가 더 길기 때문에)
- SDS-PAGE 상에서는 분자량이 큰 단백질일수록 느리게 이동함

- SDS-PAGE 에서는 분자량이 작은 단백질일수록 이동하는 속도가 빠름
- 단백질 분자량 크기의 순서가 A>B>C이면 SDS-PAGE에서 이동하는 속도의 순서는 A < B < C 임
- Western blot은 Ag-Ab 반응을 이용한 특정 단백질 검색법임
- ELISA 법도 Ag-Ab 반응을 이용한 특정 단백질 검색법임
- Ion-Exchange chromatograph는 단백질의 전하를 이용한 분리정제법임
- Affinity chromatography는 항원항체 반응을 이용하여 단백질을 정제함
'생명과학' 카테고리의 다른 글
| 핵폭탄 핵무기 대비 (러시아 요오드) (0) | 2022.09.29 |
|---|---|
| 겨울잠 원리 (동면) / 갓난 아기가 추워도 떨지 않는 이유 (0) | 2022.09.27 |